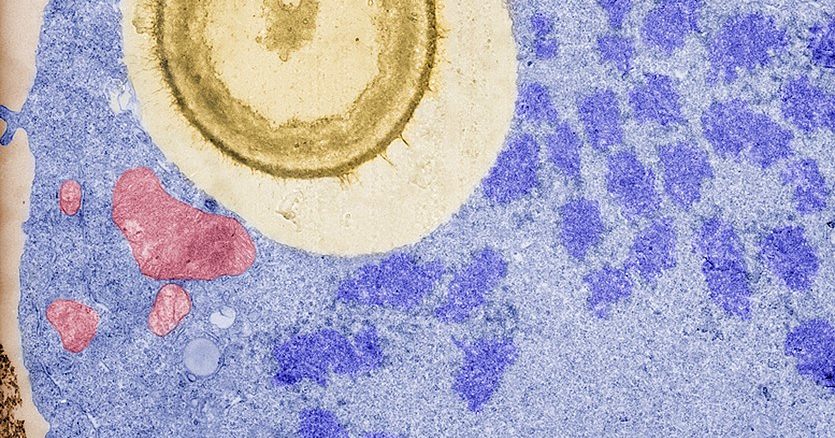
Makrophagen (hellblau) nehmen den Pilzerreger Cryptococcus neoformans (hellgelber Kreis) auf. Trotzdem machen sie eine Zellteilung durch und man kann kondensierte Chromosomen (dunkelblau) und das Fehlen der Kernhülle erkennen. In Rot sind die Makrophagen-Mitochondrien hervorgehoben. Foto: Carolina Coelho, Lizenz: CC BY-SA 4.0
Wie Makrophagen Natrium schmecken
Makrophagen spielen als Zellen des angeborenen Immunsystems in der Pathogen-Erkennung und Infektionsabwehr eine entscheidende Rolle. Zusätzlich tragen sie zur Geweberegeneration bei und übernehmen homöostatische ‚Hausmeister‘-Funktionen in verschiedenen Organen. Dazu beproben Makrophagen kontinuierlich ihre Umgebung und reagieren auf verschiedene Arten von Umgebungsfaktoren. Zur Entschlüsselung des Mikromilieus dienen ihnen verschiedene Rezeptoren, die Lipide, Proteine, Zucker und Nukleinsäuren erkennen können. Aktivierung dieser Rezeptoren erzeugt definierte Signalkaskaden, die es den Makrophagen ermöglichen, sich an die jeweilig vorgefundene Situation anzupassen.
Das Gewebemikromilieu wird aber nicht nur durch die Verfügbarkeit organischer Substanzen bestimmt. So können Entzündungen und Infektionen eine lokale Anhäufung von Natrium im Gewebe hervorrufen, die sowohl die inflammatorische Aktivität als auch die antimikrobielle Schlagkraft von Makrophagen steigern kann. Wie jedoch nehmen Makrophagen Veränderungen in der lokalen Ionenbilanz und insbesondere erhöhte Natrium-Verfügbarkeit in ihrer Umgebung wahr?
Die Arbeitsgruppe von Prof. Dr. Jonathan Jantsch am Institut für Klinische Mikrobiologie und Hygiene des Universitätsklinikums Regensburg hat in Zusammenarbeit mit weiteren Forschergruppen beobachtet, dass es nach einer Erhöhung extrazellulärer Natrium-Verfügbarkeit zu einem raschen Einstrom von Natrium in Makrophagen gekommen ist, der von einem Calcium-Ausstrom begleitet war. Dies deutete darauf hin, dass Natrium/Calcium-Austauschprozesse eine wichtige Rolle in der Natrium-Wahrnehmung der Makrophagen spielen. Eine Blockade des in Makrophagen exprimierten Natrium/Calcium-Austauschers (NCX) störte nicht nur den Natrium-Einstrom unter Hochsalzbedingungen, sondern hemmte auch die sonst nach erhöhter Natrium-Exposition beobachtete gesteigerte entzündliche und antimikrobielle Makrophagen-Aktivität.
Bisher war unbekannt, über welche Mechanismen Makrophagen Natrium erkennen. Diese Arbeit entschlüsselt eine wichtige Komponente des Natrium-Detektionsapparats der Makrophagen und weist dem NCX dabei eine zentrale Rolle zu. Dies eröffnet vollständig neue Möglichkeiten, die Makrophagen-Funktion zu beeinflussen.
Originalpublikation: P. Neubert, A. Homann, D. Wendelborn, A. Bär, L. Krampert, M. Trum, A. Schröder, S. Ebner, A. Weichselbaum, V. Schatz, P. Linz, R. Veelken, J. Schulte-Schrepping, A. C. Aschenbrenner, T. Quast, C. Kurts, S. Geisberger, K. Kunzelmann, K. Hammer, K. J. Binger, J. Titze, D. N. Müller, W. Kolanus, J. L. Schultze, S. Wagner, J. Jantsch, „NCX1 represents an ionic Na+ sensing mechanism in macrophages“, PLOS Biology (2020). DOI: 10.1371/journal.pbio.3000722
Textquelle: Christina Glaser, Universität Regensburg
Bildquelle: Makrophagen (hellblau) nehmen den Pilzerreger Cryptococcus neoformans (hellgelber Kreis) auf. Trotzdem machen sie eine Zellteilung durch und man kann kondensierte Chromosomen (dunkelblau) und das Fehlen der Kernhülle erkennen. In Rot sind die Makrophagen-Mitochondrien hervorgehoben. Foto: Carolina Coelho, Lizenz: CC BY-SA 4.0