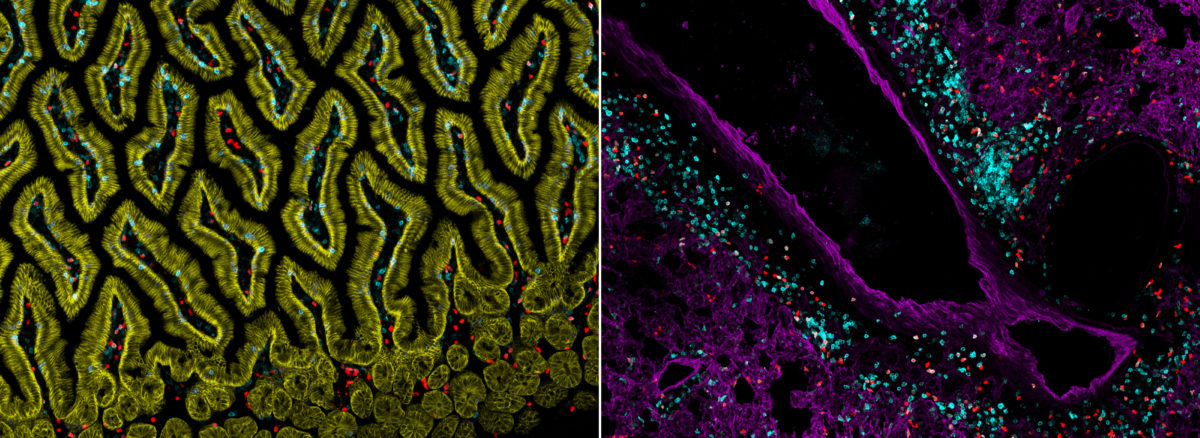
Immunzellen in verschiedenen Geweben, hier zum Beispiel ILC2s (rot) oder T‑Zellen (blau) in der Lunge (rechts) oder in der Schleimhaut des Dünndarms (links). Bilder: Ye Ouyang / Georg Gasteiger
Immunzellen zu Gast in Geweben
Spezialisierte Immunzellen siedeln sich dauerhaft in Geweben des Körpers an und bilden »lokale Eingriffstruppen«. Forscher der Universität Würzburg und aus Freiburg haben nun herausgefunden, wie sich diese Zellen vor Ort erneuern und an ihre Umgebung anpassen.
Wenn Krankheitserreger in den menschlichen Körper eindringen, ist eine schnelle Reaktion gefragt, um den Schaden so gering wie möglich zu halten. Quasi an vorderster Front der Immunantwort stehen spezielle Immunzellen, die sich in Schleimhautgeweben wie Lunge, Haut und Darm aufhalten, wo sie frühzeitig den Kampf gegen die schädlichen Eindringlinge aufnehmen. Ihr Name: angeborene lymphatische Zellen oder – kurz – ILCs. Eine der besonderen Eigenschaften dieser Zellen ist, dass sie nicht, wie viele andere Immunzellen, erst alarmiert und an ihren Einsatzort an den Grenzflächen unseres Körpers wandern müssen: ILCs siedeln sich schon kurz nach der Geburt in den Geweben und Organen an und verharren dauerhaft vor Ort.
Suche nach Vorläuferzellen
Über den Lebenszyklus dieser Zellen war bislang nur wenig bekannt. Das hat sich jetzt geändert: Wissenschaftlerinnen und Wissenschaftler der Max-Planck-Forschungsgruppe am Institut für Systemimmunologie der Julius-Maximilians-Universität Würzburg (JMU) haben ILCs in der Lunge untersucht. Diese Immunzellen spielen eine eine Rolle bei Asthma, aber auch bei viralen und parasitären Infektionen: »Wir wollten verstehen, wie ILCs entstehen und wie sie sich auf Ihre Umgebung spezialisieren«, erklärt Professor Georg Gasteiger, Inhaber des Lehrstuhls für Systemimmunologie II, »und wir haben uns gefragt, ob es gewebespezifische Vorläuferzellen gibt, die erklären könnten, wie sich diese lokalen Abwehrzellen vor Ort erneuern können.«
Dafür haben die Würzburger Forscher zusammen mit Kollegen des Max-Planck-Instituts in Freiburg sämtliche mRNA-Moleküle einzelner ILCs in der Lunge gemessen. Aus diesen »molekularen Fingerabdrücken« haben sie mit Methoden des maschinellen Lernens die Entwicklung der Lungen-ILCs abgeleitet, und diese dann in ausgeklügelten experimentellen Systemen getestet.
Ein umfassender Atlas lokaler Abwehrzellen
Die Ergebnisse ihrer Arbeit sind jetzt in der Fachzeitschrift Immunity erschienen. »Uns ist es gelungen, einen umfassenden Atlas aller ILCs zu erstellen, die in der Lunge vorkommen. Gleichzeitig konnten wir verschiedene Arten von Vorläuferzellen identifizieren: solche, die im Körper zirkulieren und andere, die sich dauerhaft in der Lunge ansiedeln«, beschreibt Georg Gasteiger das zentrale Ergebnis der jetzt publizierten Studie. »Die Arbeit zeigt, wie sich Immunzellen aus verschiedenen Quellen an lokale Gewebenischen anpassen, und legt nahe, dass nicht die Herkunft, sondern lokale Wechselwirkungen in diesen Nischen Schlüsselfaktoren sind, die die Identität und Funktion von ILCs beeinflussen.«
ILCs übernehmen viele Aufgaben
Tatsächlich lassen sich ILCs in vielen Geweben des Körpers nachweisen. Dort interagieren sie mit anderen Zelltypen, bauen eine Barriere gegen schädliche Eindringlinge mit auf, kümmern sich um die Immunantwort, setzen Entzündungsreaktionen in Gang und helfen bei Reparaturarbeiten. In der Lunge haben die Würzburger Forscher eine spezielle Unterart untersucht – sogenannte ILC2s. Diese spielen eine wichtige Rolle bei der Immunabwehr gegen parasitäre Infektionen, werden aber auch mit Asthma in Verbindung gebracht. Zusätzlich übernehmen sie eine Schlüsselfunktion, wenn es darum geht, die Lunge bei Virusinfektionen vor Gewebeschäden zu schützen.
Einwanderer unterstützen die ortsansässigen Zellen
Zwar sei aus früheren Studien der Würzburger Systemimmunologen bekannt gewesen, dass ILC2s während einer Infektion auch aus anderen Geweben in die Lunge »einwandern« können. Unklar war jedoch, ob diese mobilen Zellen nur vorübergehend die lokalen Abwehrzellen mit spezialisierten Funktionen unterstützen, oder ob sie das Gewebe tatsächlich dauerhaft besiedeln, um den lokalen Pool an residenten Zellen aufzufüllen.
Um diese Mechanismen aufzuklären, haben die Würzburger Wissenschaftler zusammen mit Kollegen in Freiburg, Berlin, Marseille und New York einen umfassenden Einzelzell-Atlas der ILC-Populationen im Knochenmark und Lungengewebe unter normalen, physiologischen Bedingungen und während einer parasitären Wurminfektion erstellt. Dabei stießen sie auf Vorläuferzellen, die aus dem Knochenmark einwandern und das Potenzial haben, während der Infektion das gesamte Spektrum von Lungen-ILC2s zu erzeugen. Diese Zellen konnten sie auch im peripheren Blut und in Lungenproben von Tumorpatienten nachweisen.
Basierend auf diesen Erkenntnissen können diese Zellen nun auch aus dem Blut von Patienten isoliert werden, um zu untersuchen, wie sie bei verschiedenen Erkrankungen verändert sind. Die Forscher wollen weiter herausfinden, wie diese Zellen im Labor vermehrt und für zelluläre Immuntherapien eingesetzt werden können.
Originalpublikation:
In situ maturation and tissue adaptation of type 2 innate lymphoid cell progenitors. Patrice Zeis, Mi Lian, Xiying Fan, Josip S. Herman, Daniela C. Hernandez, Rebecca Gentek, Shlomo Elias, Cornelia Symowski, Konrad Knöpper, Nina Peltokangas, Christin Friedrich, Remi Doucet-Ladeveze, Agnieszka M. Kabat, Richard M. Locksley, David Voehringer, Marc Bajenoff, Alexander Y. Rudensky, Chiara Romagnani, Dominic Grün, Georg Gasteiger. Immunity 53, 1–18, online / epub ahead of print 30.09.2020. DOI: https://doi.org/10.1016/j.immuni.2020.09.002
Textquelle: Gunnar Bartsch, Julius-Maximilians-Universität Würzburg
Bildquelle: Immunzellen in verschiedenen Geweben, hier zum Beispiel ILC2s (rot) oder T‑Zellen (blau) in der Lunge (rechts) oder in der Schleimhaut des Dünndarms (links). Bilder: Ye Ouyang / Georg Gasteiger